您现在的位置是: 首页 > 教育改革 教育改革
化学高考难题辅导书,化学高考难题
tamoadmin 2024-05-29 人已围观
简介1.化学的难题!!!大家帮下我嘛 快高考了谢谢大家2.高中电化学难题 有人敢挑战下吗 高手请现身吧 是一道高考题 期待专家满意答案3.急!求化学高考题25. 胃酸成分为盐酸(HCl)。常见的抗酸药成分包括碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等,其与胃酸反应的化学方程式及离子方程式分别为:NaHCO3 + HCl = NaCl + H2O + CO2 HCO3- + H+ = H2O + C
1.化学的难题!!!大家帮下我嘛 快高考了谢谢大家
2.高中电化学难题 有人敢挑战下吗 高手请现身吧 是一道高考题 期待专家满意答案
3.急!求化学高考题
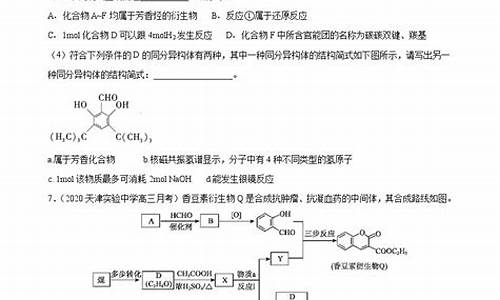
25. 胃酸成分为盐酸(HCl)。常见的抗酸药成分包括碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等,其与胃酸反应的化学方程式及离子方程式分别为:
NaHCO3 + HCl = NaCl + H2O + CO2 HCO3- + H+ = H2O + CO2
CaCO3 + 2HCl = CaCl2 + H2O +CO2 CaCO3 + 2H+ = Ca2+ +H2O + CO2
MgCO3 + 2HCl = MgCl2 + H2O + CO2 MgCO3 + 2H+ = Mg2+ + H2O + CO2
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al( OH)3 + 3H+ = Al3+ + 3H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O Mg(OH)2 + 2H+ = Mg2+ + 2H2O
26. 麻黄碱属于天然中草药,是国际奥委会严格禁止的兴奋剂。
27. R表示处方药,OTC表示非处方药。
28. 合金是由两种或两种以上的金属 (或金属与非金属)熔合而成的具有金属特性的物质。与各成分的金属相比,其具有硬度大,熔点低的特点。
29. 金属的腐蚀可以分为化学腐蚀和电化学腐蚀,在潮湿环境中发生的腐蚀属于电化学腐蚀。
30. 生铁和钢是含碳量不同的的两种铁合金。
31. 铁发生电化学腐蚀时的负极反应为Fe-2e-=Fe2+
32. 防止金属腐蚀的方法有:①改变其内部结构(如制成不锈钢);②在金属表面添加保护膜(如刷漆、涂油、加塑料膜等);③在要保护的金属上连接一块比该金属更活泼的金属(如Fe表面镀Zn等)。
33. 制造普通玻璃的主要原料是纯碱(Na2CO3)、石灰石(CaCO3)、石英(SiO2),普通玻璃的成分为Na2SiO3、CaS iO3和SiO2,主要成分是SiO2。
34. 制造陶瓷的主要原料是黏土。
35. 制造水泥的原料有石灰石和黏土。其主要成份是硅酸三钙、硅酸二钙、铝酸三钙。水泥具有水硬性,存放时应注意防潮。
36. 光导纤维的主要成分为SiO2,简称光纤。
37. 通常所说的三大合成材料是指塑料、合成纤维和合成橡胶。
38. 塑料分为热塑性塑料和热固性塑料两种。
39. 正常雨水偏酸性,pH约为5.6。酸雨是指pH小于5.6的降水,主要是SO2和NO2等酸性气体转化而成的。
SO2→H2SO4 SO2+H2O H2SO3 2H2SO3+O2 = 2H2SO4
NO→HNO3 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
40. 氟氯代烷会破坏臭氧层,这是由于氟氯代烷在紫外线的照射下分解出氯原子,对臭氧变为氧气起催化作用。
41. SO2主要来源于煤的燃烧,NO2主要来源于汽车尾气。
42. 温室气体CO2的主要来源:化石燃料的燃烧、乱砍滥伐等导致森林面积急剧减少等
43. 使用石灰石对煤炭进行脱硫其化学方程式为: 2CaCO3+2SO2+O2==2CaSO4 +2CO2
44. 汽车尾气系统中装置催化转化器,其化学方程式为2CO+2NO 2CO2+N2
45. 装修材料的黏合剂中含有甲醛,天然大理石中含有放射性元素氡。
46. 生活污水的N、P等元素会引起水体的富营养化。
47. 明矾[KAl(SO4)2·12H2O]是常用的混凝剂,
其净水的原理是:Al3++3H2O Al(OH)3(胶体)+3H+
48. 酸性和碱性废水采用中和法处理
49. 含重金属离子的污水主要用 沉淀法处理
50. “白色污染”指的是废塑料制品引起的污染
51. 某垃圾箱上贴有如右图所示的标 志的含义是:可回收垃圾1. 葡萄糖分子式C6H12O6,葡萄糖是单糖,不能水解。
2. 葡萄糖的检验方法有:(1)在碱性、加热的条件下,与银氨溶液反应析出银。该反应被称为葡萄糖的银镜反应。(2)在碱性、加热的的条件下,与新制氢氧化铜反应产生砖红色沉淀(Cu2O)。
3. 葡萄糖为人体提供能量的化学方程式:C6H12O6+6O2 6CO2+6H2O。
4. 淀粉是一种多糖,分子式(C6H10O5)n,其水解的最终产物为葡萄糖,其化学方程式为:(C6H10O5)n(淀粉)+nH2O nC6H12O6(葡萄糖)。
5. 淀粉的检验:加碘水(I2)变成蓝色。
6. 棉花、麻的成分为纤维素,其分子式为(C6H10O5)n,是一种多糖,其水解的最终产物为葡萄糖。
7. 油脂的主要成分为高级脂肪酸甘油酯,是单位质量提供热量最多的物质。
8. 油脂在 酸性或酶的作用条件下水解生成高级脂肪酸和甘油;在碱性条件下水解生成高级脂肪酸盐和甘油,油脂的碱性水解 又称为皂化反应。
9. 氨基酸的通式为 ,分子中所包含的官能团有氨基(—NH2)和羧基(—COOH)。
10.羊毛、蚕丝属于蛋白质。鉴别真丝的简单方法:灼烧有烧焦羽毛气味[来源:学科网ZXXK]
11.蛋白质的盐析是指向蛋白质溶液中加入某些浓的无机轻金属盐(如:NaCl、(NH4)2SO4、Na2SO4)后,蛋白质发生凝聚从溶液中析出的过程。盐析是一个可逆 过程。利用该反 应可 以进行蛋白质的分离和提纯。
12.能使蛋白质发生变性有铜盐、钡盐等,误食重金属离子后应喝大量牛奶解毒。
13.人体有8种氨基酸自身不能合成,称为必需氨基酸。
14.维生素按照其不同的溶解性,分为脂溶性维生素(如维生素A、D、E和K)和水溶性维生素(如维生素C、B族)。
15.维生素C又称抗坏血酸,是一种水溶性维生素,具有酸性和还原性,广泛存在于新鲜水果和绿色蔬菜中。
16.碘是人体必需的微量元素,有“智力元素”之称。其中一半左右集中在甲状腺内。在食物中,海带、海鱼等海产品中含碘最多。加碘盐中添加的是碘酸钾(KIO3)。
17.铁是人体中必需微量元素中含量最多的一种。缺铁会发生缺铁性贫血。含铁较多的食物有动物内脏、动物全血、肉类、鱼类、蛋类等。
18. 食物的酸碱性是按食物代谢产物的酸碱性分类的。
酸性食物 所含元素C、N、S、P等非金属元素
举例 富含蛋白质的物质如:肉类、蛋类、鱼类
碱性食物 K、Na、Ca、Mg等金属元素
举例 蔬菜、水果等
19. 正常情况下,人体血液的pH总保持弱碱性 范围(7.35~7.45)。长期以来,我国居民由于摄入蔬菜水果偏少,一般尿液偏酸性。
20. 婴儿食品内不能加入任何着色 剂。
21. 常用的调味剂有食盐、醋、味精、糖等。
22. 常用的防腐剂有苯甲酸钠、山梨酸钾、亚硝酸钠 。亚硝酸钠既是防腐剂又是抗氧 化剂,还是食品发色剂。
23.阿司匹林具有解热镇痛作用。
24. 青霉素是重要的抗生素即消炎药,在使用之前要进行皮肤敏感试验(皮试),以防止过敏反应的发生。
化学的难题!!!大家帮下我嘛 快高考了谢谢大家
问:化学的难点是哪些?复习的时候哪些是我们需要重点突破的地方?
郭孟雄:根据学生的不同的情况,难点也有不同,总体来说有几个比较重要的地方,一个是物质的量,一个是元素周期表、周期律,电离平衡、有机等等,都是比较重要的,其他的章节,比如元素及其化合物,一般是结合在元素、元素周期表里一起考察的,刚才说的几点是比较重要的地方,关键是对于概念的理解和认识,是要求比较高的。如果对概念的认识不到位,解题就会出错。高考的考察是比较系统的,如果认识上有偏差,恐怕解题的时候会遇到困难。
问:跟其他的科目比起来,化学这一科目在复习上应该怎样安排时间呢?
郭孟雄:高考化学是108分左右,不是特别高分值的科目,知识比较零散,我个人认为不用花太多的时间,但是文科天天念,理科要天天练,有一定的道理,化学边学边总结,一个月进行一个总结,每天用半个小时以上的时间学习,这个就够了。这个是对于基础好的同学,基础差的就要拿一些时间来补漏洞。
高中电化学难题 有人敢挑战下吗 高手请现身吧 是一道高考题 期待专家满意答案
首先,在线性范围内吸光度与浓度呈正比。用Excel做散点图,添加趋势线,选项中显示R2和公式。R2大于0.99即可算线性良好。
0.432铁铵矾标液浓度是0.05g/500ml即25mg/L。
得到公式:A?=?0.2079c?-?0.0077,c=2.2(mg/L)
样品总共稀释50/2=25倍
样品中的铁含量是25*2.2=55mg/L=0.055g/L
急!求化学高考题
二,2作为电解池时c电极为什么不是氢离子得电子而是硫酸铅得电子?按理说氢离子得电子能力比铅离子更强。
主要是控制条件让氢产生过电位(超电势),让氢电位比硫酸铅难得电子
又如:
食盐电解工业中阴极上如何不析出氢而析出更活泼的金属钠? 利用氢在汞上的超电势较高,用汞作阴极进行电解,因此在阴极上才有可能形成汞齐而不析出氢气。 在此电解法中,Na+离子在汞阴极(含0.2%的钠汞齐)上的放电电势是-1.83V,而H+离子的理论放电电势为-0.84V,由于氢在汞上的超电势为1.35V,故氢的实际放电电势为-2.2V,因此H+离子放电要比Na+离子放电困难得多。 Na+离子放电后形成的钠汞齐是金属钠溶解在汞中所成的液态合金,后者在电解槽里生成后流到解汞室同水作用就生成烧碱和氢气,即 2Na(Hg) + 2H2O → 2NaOH + H2 + 2Hg
-----
一,2中作为电解池 d电极放电时 为什么电极材料金属铅不失电子,而是而是离子化合物硫酸铅失电子
主要是由于放电产生的硫酸铅疏松,结构不致密,活性很高,也可能是铅被硫酸铅覆盖,很多资料表明就是铅失电子,在硫酸中也生成硫酸铅,或者是超电位造成。
(2007)6.已知:C(s)+CO2(g) 2CO(g) △H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
A 升高温度和减小压强 B 降低温度和减小压强
C 降低温度和增大压强 D 升高温度和增大压强
7.0.1mol/L NaHCO3溶液的pH最接近于
A.5.6 B.7.0 C.8.4 D.13.0
8.能正确表示下列反应的离子方程式是
A 醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O
B 碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O=C6H5OH+CO32-
D 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
9.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
10.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A 正极附近的SO42―离子浓度逐渐增大 B 电子通过导线由铜片流向锌片
C 正极有O2逸出 D 铜片上有H2逸出
11.下列氧化还原反应中,水作为氧化剂的是
A CO+H2O CO2+H2 B 3NO2+H2O=2HNO3+NO
C 2Na2O2+2H2O=4NaOH+O2↑ D 2F2+2H2O=4HF+O2
12.仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是
1 2 3 4 5 6 7 8 9 ……
C2H2 C2H4 C2H6 C3H4 C3H6 C3H8 C4H6 C4H8 C4H10 ……
A C6H12 B C6H14 C C7H12 D C7H14
13.在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A Na2O B Na2O2 C Na2O和Na2O2 D Na2O2和NaO2
26.(16分)用A+、B-、C2―、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是 ① 、B元素是 ② 、C元素是 ③ (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 ④ 。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 ⑤ 。
(4)F是由两种元素组成的三原子分子,其分子式是 ⑥ ,电子式是 ⑦ 。
(5)G分子中含有4个原子,其分子式是 ⑧ 。
(6)H分子中含有8个原子,其分子式是 ⑨ 。
27.(15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
阳离子 Ag+ Ba2+ A1+
阴离子 OH- C1- SO42-
为鉴别它们,分别完成以下实验,其结果是:
① B和D都不溶于水,也不容于酸;
② A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
③ C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
④ E溶于水后,与上述某阴离子反应可生成B;
⑤ A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A ,B ,C ,E 。
(2)A溶液与过量的E溶液反应后,最终得到的化学式是 。
28.(15分)
在室温和大气压强下,用图示的装置进行实验,测得ag含CaC290%的样品与水完全反应产生的气体体积bL。现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
(1)CaC2和水反应的化学方程式是 。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是 。
(3)本实验中测量气体体积时应注意的事项有 。
(4)如果电石试样质量为cg,测得气体体积为dL,则电石试样中CaC2的质量分数计算式w(CaC2)= 。(杂质所生成的气体体积忽略不计)。
29.(15分)
某有机化合物X(C3H2O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2):
X+Y Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应。则X是 (填标号字母)。
(2)Y的分子式是 ,可能的结构简式是: 和 。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得F(C4H8O3)。F可发生如下反应:
该反应的类型是 ,E的结构简式是 。
(4)若Y与E具有相同的碳链,则Z的结构简式为: 。
DACBCDABC
26. (1)K C1 S
(2)HC1
(3)F2
(4)H2S H H
(5)H2O2(答PH3同样给分)
(6)C2H6
27. (1)Al2(SO4)3 AlCl3 AgCl Ba(OH)2 (2) BaSO4
28. (1)CaC2+2H2O=Ca(OH)2+C2H2↑
(2)因为装置内气体的温度没有恢复到室温,气体压强不等于大气压强。
(3)待装置内气体的温度恢复至室温后,调节量筒使其内外液面持平。
(4)
29. (1)D
(2)C4H8O2 CH3CH2CH2COOH CH3CH(CH3)COOH
(3)醋化反应(或消去反应) CH2(OH)CH2CH2CHO
(4) -CH2OOCCH2CH2CH3









