您现在的位置是: 首页 > 教育政策 教育政策
17高考有机_2021高考有机化学
tamoadmin 2024-05-15 人已围观
简介1.高考常见有机物的物理性质,包括密度,溶解性,气味,常温下状态,沸点。 卤素单质常温下及溶于水或常见1为碳碳双键卤素加成,2为卤代烷碱性环境水解,3为炔烃在钯/硫酸钡催化部分还原成烯烃,4为烯烃在镍等催化剂催化加氢还原,5为烷烃的取代,条件为光照或高温等;6为卤代烷的消去,反应条件为强碱性环境;7为烯烃与卤化氢加成,8为烯烃与水的加成,9为烯烃浓硫酸脱条件水消去,10为烯烃在银的催化下氧化生产醛
1.高考常见有机物的物理性质,包括密度,溶解性,气味,常温下状态,沸点。 卤素单质常温下及溶于水或常见
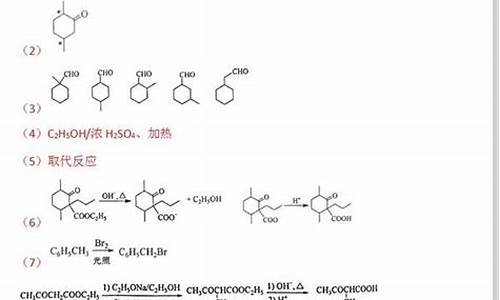
1为碳碳双键卤素加成,2为卤代烷碱性环境水解,3为炔烃在钯/硫酸钡催化部分还原成烯烃,4为烯烃在镍等催化剂催化加氢还原,5为烷烃的取代,条件为光照或高温等;6为卤代烷的消去,反应条件为强碱性环境;7为烯烃与卤化氢加成,8为烯烃与水的加成,9为烯烃浓硫酸脱条件水消去,10为烯烃在银的催化下氧化生产醛,11为同10,12同2,13为醇的卤代(HX及SO2Cl等),14,15为醇的氧化还原,16为醛的氧化,17为醇与钠的反应,18为醇分子间脱水生产醚,19,20,21,22为醇与酸的酯化及酯的水解反应;23为炔烃与卤代烃的加成;24为烯烃的加聚反应
高考常见有机物的物理性质,包括密度,溶解性,气味,常温下状态,沸点。 卤素单质常温下及溶于水或常见
我自己整理的,再加上主要反应方程式就OK啦!要的话我发给你!
有机化合物常考知识点
一、物理性质归纳(主要是对碳原子数比较少的有机物而言)
1、状态:碳原子数≤4的烃、一氯甲烷、甲醛等有机物常温呈气态;
2、气味:苯、酯有芳香气味,酚有特殊气味,醇有特殊香味,醛和酸有刺激性气味;
3、溶解性及密度:醇、醛、羧酸、氨基酸、单糖、二糖易溶于水(能和水形成氢键,增大溶解度);烃、卤代烃、硝基化合物、酯(包括油脂)都难溶于水,其中烃、一氯代烃、酯(包括油脂)密度小于水;多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯密度大于水。
二、常见的有机物及反应类型
、表格
三、常见有机物的检验和鉴定
1.能使溴水(Br2/H2O)褪色的有机物
① 通过加成反应使之褪色:含有 C=C 、—C≡C—的不饱和化合物
② 通过取代反应使之褪色:酚类(酚羟基的邻对位氢)
③ 通过氧化反应使之褪色:含有—CHO(醛基有强还原性)的有机物
④ 通过萃取使水层褪色:汽油、苯、卤代烃、酯等不溶于水、不与溴水反应的有机物
2.苯和苯酚的混合物中检验苯酚不能用浓溴水,因为生成三溴苯酚溶于苯所以无白色沉淀。
3.能使酸性高锰酸钾溶液KMnO4/H+褪色的有机物
含有 C=C、—C≡C—、—OH、—CHO、与苯环相连的侧链碳上有氢原子的芳香烃
4.与氢气发生加成的有机物
含有 C=C 、—C≡C—、苯环、—CHO、酮中羰基(羧基和酯基中碳氧双键不行)
5.与Na反应的有机物:含有—OH、—COOH的有机物
与NaOH反应的有机物:常温下,易与含有—COOH、酚羟基的有机物反应
加热时,能使卤代烃、酯发生水解反应(取代反应)
与Na2CO3反应的有机物:含有酚羟基的有机物反应生成酚钠和NaHCO3;
含有—COOH的有机物反应生成羧酸钠,并放出CO2气体。
6.能与银氨溶液、新制Cu(OH)2悬浊液(斐林试剂)反应的有机物(要在碱性溶液中进行)
含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)
注意:与Cu(OH)2反应的还有羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)。
7.能跟FeCl3溶液发生显色反应的是:酚类化合物。
8.能跟I2发生显色反应的是:淀粉(显蓝色)。
9.能跟浓硝酸发生颜色反应的是:含苯环的天然蛋白质(显**)。
10.卤代烃中卤素的检验
取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
11.蔗糖、淀粉水解产物的检验
取样,加入一定浓度硫酸加热发生水解,冷却后的水解液中加入足量的NaOH溶液,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
四、常见有机反应的反应条件
表格
五、经典转化
1、淀粉→葡萄糖→酒精→CH2=CH2→BrCH2CH2Br→HOCH2CH2OH→OHCCHO→HOOCCOOH→高分子酯
2、苯环上引入基团的方法:
六、有机综合题
1、解题思路:认真分析题目所给流程(要关注官能团种类的改变、特征反应条件、所给分子式或相对分子质量等特殊信息),结合题目另给信息,联系课本相关知识,灵活运用逆推或正推的方法完成推断。合成一般采用逆推法,根据现有原料,信息及反应规律,把目标分子分成若干片断,再设法将各片断拼接,最后标明条件。
2、注意点:一定要看清楚要求(写最简式、分子式、结构简式、反应方程式、反应流程等);
方程式一定不要漏写小分子产物,要按题目信息或我们已学知识写好反应条件;
要注意基团(酚羟基、醛基、碳碳双键)及特定位置(苯环对位或邻位)的保护;
注意反应条件中酸碱性对反应产物中羧基及酚羟基的影响。
1.状态 固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸16.6℃以下 气态:C4以下的烷、烯炔、甲醛、一氯甲烷 液态:油 状: 硝基苯、溴乙烷、乙酸乙酯、油酸 粘稠状: 石油、乙二醇、丙三醇
2. 气味 无味:甲烷、乙炔常因混有PH3、H2S和AsH3而带有臭味 稍有气味:乙烯 特殊气味:苯及同系物、萘、石油、苯酚 刺激性:甲醛、甲酸、乙酸、乙醛 甜味:乙二醇、丙三醇、蔗糖、葡萄糖 香味:乙醇、低级酯 苦杏仁味:硝基苯
3. 颜色 白色:葡萄糖、多糖 淡**:TNT、不纯的硝基苯 黑色或深棕色:石油
4. 密度 比水轻的:苯、一氯代烃、乙醇、低级酯、汽油 比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、 溴代烃、碘代烃
5. 挥发性:乙醇、乙醛、乙酸
6. 升华性:萘、蒽 7. 水溶性 : 不溶:高级脂肪酸、、酯、硝基苯、溴苯、甲烷、乙烯、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4 能溶:苯酚0℃时是微溶 微溶:乙炔、苯甲酸 易溶:甲醛、乙酸、乙二醇、苯磺酸 与水混溶:乙醇、苯酚70℃以上 、乙醛、甲酸、丙三醇
化学性质:
Cl2气体,黄绿色;
Cl2水,浅黄绿色
液Br2,深棕红色;
Br2蒸气,红棕色;
溴水,橙**;
Br2的CCl4等有机溶液,橙红色
I2固体,紫黑色;
I2蒸气,紫红色;
碘水,棕**;
I2的酒精溶液(与水混溶的),棕**;
I2的CCl4(或者苯、汽油等于水不混溶的),紫红色
下一篇:录取的朋友圈,录取朋友圈搞笑评论









