您现在的位置是: 首页 > 教育政策 教育政策
高考化学非金属及其化合物,高考化学非金属
tamoadmin 2024-08-01 人已围观
简介1.高考化学常考的知识点有哪些?2.高考化学必考知识点及题型归纳3.高中化学竞赛常考的重要化学方程式有哪些?4.高考化学5.求高中化学全部的化学方程式化学方程式大全2007-11-19 21:44非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si) 1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===Xe
1.高考化学常考的知识点有哪些?
2.高考化学必考知识点及题型归纳
3.高中化学竞赛常考的重要化学方程式有哪些?
4.高考化学
5.求高中化学全部的化学方程式
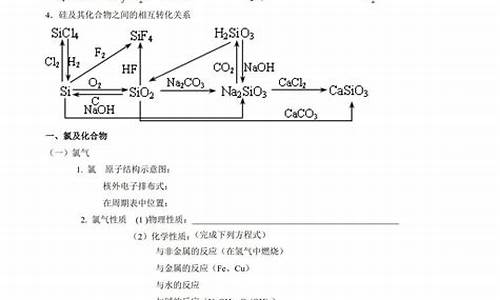
化学方程式大全2007-11-19 21:44非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
3,(碱中)歧化
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O
3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4
3C+CaO===CaC2+CO
3C+SiO2===SiC+2CO
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2 高中化学方程式大全
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小苏打,苏打)
4,不稳定性:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
3 高中化学方程式大全
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂
P2O5+3H2SO4(浓)===2H3PO4+3SO3)
CO2+H2O===H2CO3
4,与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
4 回复:高中化学方程式大全
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3,酸性:
H2SO4(浓) +CaF2===CaSO4+2HF
H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓) +2NaCl===Na2SO4+2HCl
H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr
H3PO4(浓)+NaI===NaH2PO4+HI
4,不稳定性:
2HClO===2HCl+O2
4HNO3===4NO2+O2+2H2O
H2SO3===H2O+SO2
H2CO3===H2O+CO2
H4SiO4===H2SiO3+H2O
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?)
NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O
Al(OH)3+NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO+H2O
2Al(OH)3===Al2O3+3H2O
2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
5 回复:高中化学方程式大全
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO4
3,与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl
AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4,与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl
Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2
3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2
3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S
3NaAlO2+AlCl3+6H2O===4Al(OH)3
5,不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O
NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2
2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2
2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2
2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2
CaCO3===CaO+CO2
MgCO3===MgO+CO2
高中化学方程式总结
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
高考化学常考的知识点有哪些?
高中化学所有的化学方程式 (我复制来的,至于你有没有用,就不知道了,你可以稍加整理一下--)
一. 非金属单质(F2,Cl2,O2,S,N2,P,C,Si)
1、氧化性:
F2+H2===2HF F2+Xe(过量)===XeF2 2F2(过量)+Xe===XeF4
nF2+2M===2MFn(表示大部分金属) 2F2+2H2O===4HF+O2
2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2
F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 F2+Cl2(等体积)===2ClF
3F2(过量)+Cl2===2ClF3 7F2(过量)+I2===2IF7
Cl2+H2===2HCl 3Cl2+2P===2PCl3 Cl2+PCl3===PCl5
Cl2+2Na===2NaCl 3Cl2+2Fe===2FeCl3 Cl2+2FeCl2===2FeCl3
Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2+2NaI===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl Cl2+Na2S===2NaCl+S
Cl2+H2S===2HCl+S Cl2+SO2+2H2O===H2SO4+2HCl Cl2+H2O2===2HCl+O2
2O2+3Fe===Fe3O4 O2+K===KO2
S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S
3S+2Al===Al2S3 S+Zn===ZnS
N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2
N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N
N2+6Rb===2Rb3N
P4+6H2===4PH3 P+3Na===Na3P 2P+3Zn===Zn3P2
2、还原性
S+O2===SO2 S+H2SO4(浓)===3SO2+2H2O
S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4HNO(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5) 2P+3X2===2PX3(X表示F2,Cl2,Br2)
PX3+X2===PX5 P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4 C+2Cl2===CCl4 2C+O2(少量)===2CO
C+O2(足量)===CO2 C+CO2===2CO C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4 (SiCl4+2H2===Si(纯)+4HCl) Si(粉)+O2===SiO2
Si+C===SiC(金刚砂) Si+2NaOH+H2O===Na2SiO3+2H2
3、(碱中)歧化
Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O 3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4
3C+CaO===CaC2+CO 3C+SiO2===SiC+2CO
二.金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH 4Na+O2===2Na2O 2Na2O+O2===2Na2O2
2Na+O2===Na2O2 2Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2 4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2 Mg+Br2===MgBr2 2Mg+O2===2MgO
Mg+S===MgS Mg+2H2O===Mg(OH)2+H2
2Mg+TiCl4(熔融)===Ti+2MgCl2 Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C 2Mg+SiO2===2MgO+Si Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3 4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg(铝汞齐)
4Al+3MnO2===2Al2O3+3Mn 2Al+Cr2O3===Al2O3+2Cr 2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe 2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O 2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3 Fe+I2===FeI2 Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2 Fe+2HCl===FeCl2+H2 Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)
三.非金属氢化物(HF,HCl,H2O,H2S,NH3)
1、还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O 4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2 2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O 2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O 3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
2 高中化学所有的化学方程式
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O 2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl 4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O 4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2 4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2、酸性:
4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2 H2S+CuCl2===CuS+2HCl H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===FeS+2HCl
2NH3+2Na==2NaNH2+H2 (NaNH2+H2O===NaOH+NH3)
3、碱性:
NH3+HCl===NH4Cl NH3+HNO3===NH4NO3 2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)
4、不稳定性:
2HF===H2+F2 2HCl===H2+Cl2 2H2O===2H2+O2 2H2O2===2H2O+O2
H2S===H2+S 2NH3===N2+3H2
四.非金属氧化物
1、低价态的还原性:
2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)
2SO2+O2===2SO3 SO2+Cl2+2H2O===H2SO4+2HCl SO2+NO2===SO3+NO
SO2+Br2+2H2O===H2SO4+2HBr SO2+I2+2H2O===H2SO4+2HI
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2 CO+CuO===Cu+CO2 3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
2、氧化性:
SO2+2H2S===3S+2H2O SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O 2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O SiO2+2Mg===2MgO+Si
3、与水的作用:
SO2+H2O===H2SO3 SO3+H2O===H2SO4 3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3 P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂)
P2O5+3H2SO4(浓)===2H3PO4+3SO3 CO2+H2O===H2CO3
4、与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3 SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4 SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O 2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3 CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3 SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2 SiO2+CaCO3===CaSiO3+CO2
五.金属氧化物
1、低价态的还原性:
6FeO+O2===2Fe3O4 FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2、氧化性:
Na2O2+2Na===2Na2O(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O(制还原铁粉) Fe3O4+4H2===3Fe+4H2O
3、与水的作用:
Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2(缓慢反应)
4、与酸性物质的作用:
Na2O+SO3===Na2SO4 Na2O+CO2===Na2CO3 Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2 Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4 MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是氧化物:Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
3 高中化学所有的化学方程式
六.含氧酸
1、氧化性:
4HClO3+3H2S===3H2SO4+4HCl HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O 2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al)室温下钝化 6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O 4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O 5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O 4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O 36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2、还原性:
H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2) 2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O 5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3、酸性:
H2SO4(浓)+CaF2===CaSO4+2HF H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓)+2NaCl===Na2SO4+2HCl H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3 2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr, SO2等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr H3PO4(浓)+NaI===NaH2PO4+HI
4、不稳定性:
2HClO===2HCl+O2 4HNO3===4NO2+O2+2H2O H2SO3===H2O+SO2
H2CO3===H2O+CO2 H4SiO4===H2SiO3+H2O
七.碱
1、低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2、与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O 2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?) NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O Al(OH)3+NH4Cl不溶解
3、不稳定性:
Mg(OH)2===MgO+H2O 2Al(OH)3===Al2O3+3H2O 2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八.盐
1、氧化性:
2FeCl3+Fe===3FeCl2 2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2 FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag不反应
2FeCl3+H2S===2FeCl2+2HCl+S 2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2、还原性:
2FeCl2+Cl2===2FeCl3 3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O 2Na2SO3+O2===2Na2SO4
3、与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4、与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2 3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2 3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S 3NaAlO2+AlCl3+6H2O===4Al(OH)3
5、不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2 2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2 2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2 2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2 CaCO3===CaO+CO2 MgCO3===MgO+CO2
高考化学必考知识点及题型归纳
有很多 ,没写完。以后学了 高三就会系统复习。 高考化学常考知识点
Ⅰ、基本概念与基础理论:
一、阿伏加德罗定律
1.内容:在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。
2.推论
(1)同温同压下,V1/V2=n1/n2 (2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1 (4)同温同压同体积时,M1/M2=ρ1/ρ2
注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT有助于理解上述推论。
3、阿伏加德罗常这类题的解法:
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。
二、离子共存
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存;Fe3+与 不能大量共存。
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
三、离子方程式书写的基本规律要求
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
(4)两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
(5)明类型:分清类型,注意少量、过量等。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
四、氧化性、还原性强弱的判断
(1)根据元素的化合价
物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
(2)根据氧化还原反应方程式
在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据反应的难易程度
注意:①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氧化还原反应。
常见氧化剂:
①、活泼的非金属,如Cl2、Br2、O2 等;
②、元素(如Mn等)处于高化合价的氧化物,如MnO2、KMnO4等
③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等
④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7
⑤、过氧化物,如Na2O2、H2O2等。
常见还原剂
①、活泼的金属,如Na、Al、Zn、Fe 等;
②、元素(如C、S等)处于低化合价的氧化物,如CO、SO2等
③、元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等
④、元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等
⑤、某些非金属单质,如H2 、C、Si等。
五、元素氧化性,还原性变化规律表
(1)常见金属活动性顺序表(联系放电顺序)
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb(H),Cu,Hg,Ag,Pt,Au(还原能力-失电子能力减弱)K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+(H+),Cu2+,Hg2+,Ag+(氧化能力-得电子能力增强)(2)非金属活动顺序表
F O Cl Br I S(氧化能力减弱)F- Cl- Br- I- S2-(还原能力增强)
比较金属性强弱的依据
金属性:金属气态原子失去电子能力的性质;
金属活动性:水溶液中,金属原子失去电子能力的性质。
注:金属性与金属活动性并非同一概念,两者有时表现为不一致,
1、同周期中,从左向右,随着核电荷数的增加,金属性减弱;
同主族中,由上到下,随着核电荷数的增加,金属性增强;
2、依据最高价氧化物的水化物碱性的强弱;碱性愈强,其元素的金属性也愈强;
3、依据金属活动性顺序表(极少数例外);
4、常温下与酸反应煌剧烈程度;5、常温下与水反应的剧烈程度;
6、与盐溶液之间的置换反应;7、高温下与金属氧化物间的置换反应。
比较非金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强;
同主族中,由上到下,随核电荷数的增加,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件;5、与盐溶液之间的置换反应;
6、其他,例:2Cu+SΔ===Cu2S Cu+Cl2点燃===CuCl2 所以,Cl的非金属性强于S。
“10电子”、“18电子”的微粒小结
(一)“10电子”的微粒:
分子 离子
一核10电子的 Ne N3
高中化学竞赛常考的重要化学方程式有哪些?
1、相对分子质量最小的氧化物是水考点衍生:氮气及其氧化物知识点 | 酸和对应的氧化物的反应
2、单质与水反应最剧烈的非金属元素是F考点衍生:水参与的非氧化还原反应 | 有关水的反应小结
3、其最高价氧化物的水化物酸性最强的元素是Cl考点衍生:含氧酸酸性方程式
4、其单质是最易液化的气体的元素是Cl
5、其氢化物沸点最高的非金属元素是O考点衍生:熔沸点大小比较规律
6、其单质是最轻的金属元素是Li考点衍生:碱金属元素知识点
7、常温下其单质呈液态的非金属元素是Br考点衍生:非金属及其化合物知识点
8、熔点最小的金属是Hg考点衍生:金属及其化合物所有知识点
9、其气态氢化物最易溶于水的元素是N考点衍生:非金属氢化物化学方程式
10、导电性最强的金属是Ag
11、相对原子质量最小的原子是H考点衍生:原子结构专项知识点 | 相对原子质量知识点
12、人体中含量最多的元素是O
13、日常生活中应用最广泛的金属是Fe
14、组成化合物种类最多的元素是C考点衍生:有机化合物重要知识点| 非金属及其化合物知识点
15、天然存在最硬的物质是金刚石考点衍生:化学物质的结构易错知识点 | 常见物质的重要用途必考知识点
16、金属活动顺序表中活动性最强的金属是K考点衍生:元素周期表考点分析 | 元素周期律和元素周期表
17、地壳中含量最多的金属元素是Al
18、地壳中含量最多的非金属元素是O
19、空气中含量最多的物质是氮气考点衍生:氮气及其氧化物知识要点
20、最简单的有机物是甲烷考点衍生:甲烷、乙烯、苯的主要特性,甲烷知识点
一、选化学政治地理可以报考的专业有哪些 新高考选科的注意事项
二、高考政治化学生物可报专业有哪些
三、高考政治化学生物可以选什么专业
四、高考选化学生物地理可选哪些专业
五、高考选化学生物地理可以报哪些大学
六、高考选化学生物地理可以报哪些专业
七、甘肃高考多少分可以上怀化学院 附2016-2017最低录取分数线
八、新疆高考多少分可以上云南大学旅游文化学院 附2016-2019最低录取分数线
九、重庆高考多少分可以上怀化学院 附2016-2020最低录取分数线
十、浙江高考多少分可以上怀化学院 附2016-2020最低录取分数线
化学实验现象总结
1.镁条在空气中燃烧:发出耀眼强光,放出很多的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生很多的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
高考化学
无机化学部分
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1. 氧化性:
F2 + H2 === 2HF
2F2 +2H2O===4HF+O2
Cl2 +2FeCl2 ===2FeCl3
Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)
2. 还原性
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4 HNO3(稀)===3SO2+4NO↑+2H2O
PX3+X2===PX5
C+CO2===2CO
(生成水煤气)
(制得粗硅)
Si+2NaOH+H2O===Na2SiO3+2H2↑
3.歧化反应(碱中)
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
金属单质(Na,Mg,Al,Fe)的还原性
4Na+O2===2Na2O
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2↑
Mg+H2SO4===MgSO4+H2↑
2Al+6HCl===2AlCl3+3H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Fe+2HCl===FeCl2+H2↑
Fe+CuCl2===FeCl2+Cu
非金属氢化物(HF,HCl,H2O,H2S,NH3)
1.还原性:
16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(实验室常用)
2H2S+SO2===3S↓+2H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+6NO === 5N2+6H2O(用氨清除NO)
2.酸性:
4HF+SiO2===SiF4↑+2H2O(HF保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO2的含量)
H2S+CuCl2===CuS↓+2HCl
H2S+FeCl2===(不反应)
3.碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3↓+NH4Cl
(此反应用于工业制备小苏打,苏打)
4.不稳定性:
2H2O2=== 2H2O+O2↑
非金属氧化物
1.低价态的还原性:
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
2NO+O2===2NO2
2CO+O2===2CO2
2.氧化性:
NO2+2KI+H2O===NO+I2↓+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
3.与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O(冷)===2HPO3
P2O5+3H2O(热)===2H3PO4
(P2O5极易吸水,可作气体干燥剂)
4.与碱性物质的作用:
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4=== (NH4)2SO4 + 2H2O + 2SO2 生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3↓+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3
SiO2+2NaOH===Na2SiO3+H2O (强碱缓慢腐蚀玻璃)
金属氧化物
1.低价态的还原性:
FeO+4HNO3===Fe(NO3)3+NO↑+2H2O
2。氧化性:
MgO,Al2O3很稳定,很难被还原为Mg,Al.,一般通过电解制Mg和Al.
(制还原铁粉
3.与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
4.与酸性物质的作用:
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
Al2O3+2NaOH===2NaAlO2+H2O (Al2O3是氧化物)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
含氧酸
1.氧化性:
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2↑
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
H2SO4+Fe(Al) 室温下钝化
H2SO4(浓)+2HBr===SO2↑+Br2↑+2H2O
H2SO4(稀)+Fe===FeSO4+H2↑
4HNO3(浓)+C===CO2↑+4NO2↑+2H2O
6HNO3(浓)+S===H2SO4+6NO2↑+2H2O
5HNO3(浓)+P===H3PO4+5NO2↑+H2O
6HNO3(浓、热)+Fe===Fe(NO3)3+3NO2↑+3H2O
4HNO3(稀)+Fe(不足)===Fe(NO3)3+NO↑+2H2O
8HNO3(稀)+3Fe(过量)===3Fe(NO3)2+2NO↑+4H2O
2.还原性:
H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3.酸性:
H2SO4(浓) +CaF2===CaSO4+2HF↑(选学)
H2SO4(浓)+NaCl===NaHSO4+HCl↑
H2SO4(浓) +2NaCl===Na2SO4+2HCl↑
H2SO4(浓)+NaNO3===NaHSO4+HNO3↑
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制H2S,HI,HBr,SO2等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
3. 不稳定性:
2HClO===2HCl+O2↑
碱
1.低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2.与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===Na2SiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3↓+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
NaOH+NH4Cl===NaCl+NH3↑+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3?H2O
Al(OH)3+NH4Cl (或NH3?H2O不溶解)
3.不稳定性:
盐
1.氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版)
2FeCl3+H2S===2FeCl2+2HCl+S↓
2FeCl3+2KI===2FeCl2+2KCl+I2↓
FeCl2+Mg===Fe+MgCl2
2.还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O
2Na2SO3+O2===2Na2SO4
3.与碱性物质的作用:
MgCl2+2NH3?H2O===Mg(OH)2↓+2NH4Cl
AlCl3+3NH3?H2O===Al(OH)3↓+3NH4Cl
FeCl3+3NH3?H2O===Fe(OH)3↓+3NH4Cl
4. 与酸性物质的作用:
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl
3Na2CO3+2FeCl3+3H2O==2Fe(OH)3↓+3CO2↑+6NaCl
3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑ + 3NaCl
3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑+ 3NaCl
3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+ 3 NaCl
5. 不稳定性:
Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O
有机化学反应方程式
1. 甲烷与氯气 CH4+Cl2 CH3Cl+HCl CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl CHCl3+Cl2 CCl4+HCl
2. 乙烯实验室制法(浓硫酸作催化剂,脱水剂) CH3CH2OH H2O + CH2=CH2 ↑
3. 乙烯通入溴水中 CH2=CH2 + Br2 CH2BrCH2Br
4.乙烯和HBr的反应 CH2=CH2 + HBr CH3CH2Br
5. 乙烯水化制乙醇 CH2=CH2 + H2O CH3CH2OH
6. 制取聚乙烯、聚丙烯 n CH2=CH2
n CH3–CH=CH2
CH3
7. 乙炔的制取 CaC2 + 2H2O Ca(OH)2 + ↑
8. 由乙炔制聚氯乙烯
+ HCl H2C=CHCl n H2C=CHCl
9. 苯与液溴反应(需铁作催化剂)
+ Br2 +HBr
10. 苯的硝化反应
+ HNO3 + H2O
11. 苯与氢气加成生成环己烷
+ 3H2
12. 甲苯发生硝化反应
+3HONO2 + 3H2O
13. 溴乙烷水解 CH3CH2Br + NaOH CH3CH2OH + NaBr
14. 溴乙烷消去反应
CH3CH2Br +NaOH CH2=CH2 + NaBr + H2O
15. 乙醇与钠反应 2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
16. 乙醇催化氧化 2CH3CH2OH + O2 2CH3CHO + 2H2O
17.乙醇脱水(分子间、分子内)CH3CH2OH H2O + CH2=CH2 ↑
2CH3CH2OH H2O + CH3CH2O CH2 CH3
18. 苯酚与氢氧化钠溶液反应
+ NaOH + H2O
19. 苯酚钠溶液中通入二氧化碳
+ CO2 + H2O + NaHCO3
20. 苯酚的定性检验定量测定方法:
+ 3Br2 ↓ + 3HBr
21. 丙醛制1-丙醇
CH3CH2CHO + H2 CH3CH2CH2OH
22. 乙醛制乙酸
2CH3CHO + O2 2CH3COOH
23. 乙醛的银镜反应
CH3CHO + 2Ag(NH3)2OH H2O + 2Ag↓+ 3NH3 + CH3COONH4
甲醛的银镜反应 HCHO + 4Ag(NH3)2OH 2H2O + 4Ag↓+6NH3 +(NH4)2CO3
24. 乙醛与新制氢氧化铜悬浊液
CH3CHO + 2Cu(OH)2 Cu2O ↓+ 2H2O + CH3COOH
25. 乙酸与氢氧化铜悬浊液
2CH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O
26. 乙酸乙酯制取(用饱和碳酸钠溶液收集)
CH3COOH + CH3CH2OH CH3COOC2H5 + H2O
27. 葡萄糖与银氨溶液
CH2OH(CHOH)4 CHO +2Ag(NH3)2OH H2O + 2Ag↓+ 3NH3 + CH2OH(CHOH)4 COO NH4
28. 蔗糖水解方程式
C12H22O11 + H2O C6H12O6 + C6H12O6
蔗糖 葡萄糖 果糖
29. 麦芽糖水解方程式
C12H22O11 + H2O 2C6H12O6
麦芽糖 葡萄糖
30. 淀粉水解
(C6H10O5)n + nH2O nC6H12O6
淀粉 葡萄糖
31. 硬脂酸甘油酯皂化反应
+3NaOH 3 C17H35COONa +
求高中化学全部的化学方程式
不行
比较非金属的非金属性的强弱有如下依据:
1.其氢化物的稳定性:氢化物越稳定,非金属性越强
2.最高价含氧酸的酸性:最高价含氧酸的酸性越强,非金属性越强
而碳酸氢钠是C元素的含氧酸盐,硝酸钠是N元素的含氧酸盐,不能比较.
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
3,(碱中)歧化
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O
3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4
3C+CaO===CaC2+CO
3C+SiO2===SiC+2CO
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在[url=]酸性[/url]环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小苏打,苏打)
4,[url=]不稳定性[/url]:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂
P2O5+3H2SO4(浓)===2H3PO4+3SO3)
CO2+H2O===H2CO3
4,与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3,酸性:
H2SO4(浓) +CaF2===CaSO4+2HF
H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓) +2NaCl===Na2SO4+2HCl
H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr
H3PO4(浓)+NaI===NaH2PO4+HI
4,不稳定性:
2HClO===2HCl+O2
4HNO3===4NO2+O2+2H2O
H2SO3===H2O+SO2
H2CO3===H2O+CO2
H4SiO4===H2SiO3+H2O
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?)
NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O
Al(OH)3+NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO+H2O
2Al(OH)3===Al2O3+3H2O
2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO4
3,与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl
AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4,与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl
Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2
3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2
3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S
3NaAlO2+AlCl3+6H2O===4Al(OH)3
5,不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O
NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2
2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2
2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2
2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2
CaCO3===CaO+CO2
MgCO3===MgO+CO2